Pengaruh Konsentrasi Terhadap Laju Reaksi
Gurubagi.com. laju reaksi merupakan perubahan konsentrasi tiap perubahan waktu atau kecepatan suatu reaktan bereaksi hingga habis.
Laju reaksi juga berarti seberapa cepat reaksi kimia membentuk zat baru. Dengan kata lain pengurangan konsentrasi molar pereaksi atau laju pertambahan konsentrasi molar hasil reaksi dalam satuan waktu.
Laju reaski menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan setiap detik. Laju reaksi mempunya satuan khusus yang bernama M/s (Molar per detik). Laju reaksi salah satunya dapat dipengaruhi oleh laju reaksi.
Untuk mengukur besaran laju dapat dilihat dari ukuran cepat atau lambat yang berpatokan pada suatu rekasi kimia.
Contohnya proses karatnya besi menjadi bagian salah satu contoh atas reaksi kimia lambat yang dapat berlangsung selama beberapa tahun.
Pada sebagian besar reaksi, laju reaksi dapat menimbulkan semakin berkurang seiring dengan berlangsungnya reaksi.
laju reaksi dipengaruhi oleh beberapa fakor, salah satunya konsentrasi zat pereaksi. Kenaikan konsentrasi mempercepat laju reaksi karena kenaikan suhu menyebabkan gerakan partikel semakin cepat.
Baca : Pengaruh Suhu Terhadap Laju Reaksi Beserta Contoh Soalnya
Untuk beberapa reaksi baikreaksi fase gas, cair dan padat kenaikan konsentrasi akan meningkatkan lau rekasi. Seperti reaksi antara asam klorida yang di tambahkan magnesium (Mg) berikut ini.
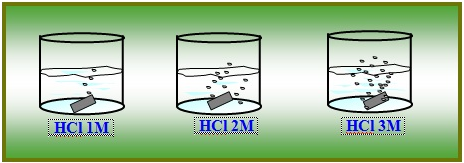
Dari gambar di atas terlihat reaksi Mg yang dicelupkan ke dalam larutan HCl dengan konsentrasi yang berbeda-beda, yaitu HCl 1M, HCl 2 M dan HCl 3M memberikan reaksi yang berbeda.
Magnesium (Mg) yang dimasukkan kedalam larutan HCl akan bereaksi dengan persamaan sebagai berikut:
Mg (s) + 2HCl (aq) →MgCl2 (aq) + H2 (g)
Menurut percobaan magnesium (Mg) yang dicelupkan ke dalam asam klorida (HCl) akan menghasilkan data sebagai berikut.
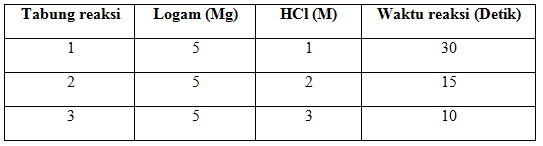
Dari data di atas dapat dijelaskan bahwa, jika larutan HCl dibuat semakin encer atau konsentrasi rendah, maka waktu yang dibutuhkan untuk Mg habis bereaksi semakin lama, sebaliknya waktu yang dibutuhkan Mg habis bereaksi dengan HCl yang pekat semakin cepat .
Dengan kata lain bahwa reaksi yang terjadi antara dua partikel karena terjdinya tumbukan dan tumbukan yang mengahsilkan reaksi disebut tumbukan efektif.
Hal ini berlaku untuk semua fase baik gas, padat dan cair, sehingga jika konsentrasi zat tinggi maka kemungkinan terjadinya tumbukan semakin banyak.
Demikian pengaruh konsentrasi terhadap laju reaksi. Semoga bermanfaat